儀器: NanoBrook 系列
引言
對于快速發(fā)展的蛋白質(zhì)治療和基于重組抗原的疫苗生產(chǎn)領(lǐng)域而言,蛋白質(zhì)制劑的穩(wěn)定性至關(guān)重要。Zeta 電位是剪切面上的表面電荷密度,是用于預(yù)測這些制劑穩(wěn)定性的參數(shù)之一。Zeta 電位還被用作配體添加后構(gòu)象變化的指標(biāo)。傳統(tǒng)的 Zeta 電位測量方法通常采用經(jīng)典的激光多普勒測速技術(shù)來測定懸浮蛋白質(zhì)的電泳遷移率。本文介紹了一種利用相位分析方法來測定 Zeta 電位的技術(shù),該技術(shù)采用了一種能夠消除電滲運動的電極設(shè)計。使用該技術(shù),可以在極其廣泛的溶劑條件下(包括接近生理離子強度的條件)測量 Zeta 電位。這極大地拓展了可測定 Zeta 電位的實驗條件范圍。
實驗
使用布魯克海文儀器公司的 NanoBrook ZetaPALS進行 Zeta 電位測量。
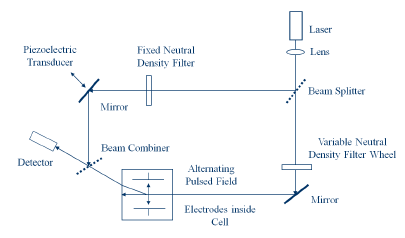
為了提高靈敏度,采用相位分析光散射(PALS)技術(shù)來檢測帶電蛋白質(zhì)的運動。傳統(tǒng)的激光多普勒電泳技術(shù)的原理是利用散射體運動引起的散射光頻率偏移來測定蛋白質(zhì)的運動。然而,通過識別并測量散射光的相位偏移,可以對粒子運動進行更為靈敏的測量1。光路設(shè)置如圖1所示。
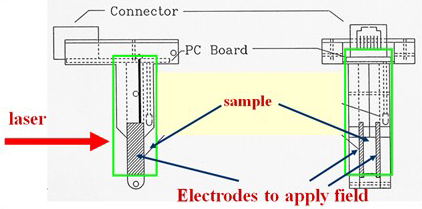
為了進一步提高靈敏度,這些測量采用了如圖2所示的Uzgiris型電極組件。這樣的電極設(shè)計可有效抑制毛細(xì)管型樣品池中的電滲運動。電滲運動是指在施加電場時,由于壁面效應(yīng)引起的流體的整體運動。這種整體運動需要最小化,因為它會干擾儀器的靈敏度。帶電蛋白質(zhì)在施加電場的作用下移動。
測量在25℃下進行。
蛋白質(zhì)購自 Sigma Aldrich,直接使用。
原理
由于 Zeta 電位與流體動力學(xué)單元上的電荷相對應(yīng),因此它是討論表面電荷最直觀的方式。然而,電泳光散射技術(shù)測量的量是電泳遷移率(μep)。
在 PALS 技術(shù)中,首先通過測量得到散射光的相位偏移(Φ),然后通過以下方程1將其與遷移率相關(guān)聯(lián)。
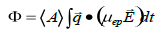
其中,<A>是平均散射振幅,q 是散射矢量,其大小為 (4πn/λ)sin(θ/2),其中 n 是介質(zhì)的折射率,λ 是用于探測樣品的光的波長,θ 是散射角。E 是施加的電場強度。積分在測量期間進行。
通過模型將電泳遷移率轉(zhuǎn)換為Zeta電位。模型的選擇取決于兩個參數(shù):顆粒大小和雙層厚度。通常,Smoluchovski模型適用于水溶液,而Huckel模型適用于非水溶液。在這里,使用如下所示的 Smoluchovski 模型將測定的電泳遷移率轉(zhuǎn)換為 Zeta 電位。
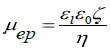
其中,ε1是液體的介電常數(shù),ε0是真空的介電常數(shù),η是液體粘度。
參考文獻
1Mobility Measurements by Phase Analysis, Walther W. Tscharnuter, Applied Optics, 40(24), August 2001, 3995-4003


結(jié)果
相位分析中典型的相位-時間曲線圖。
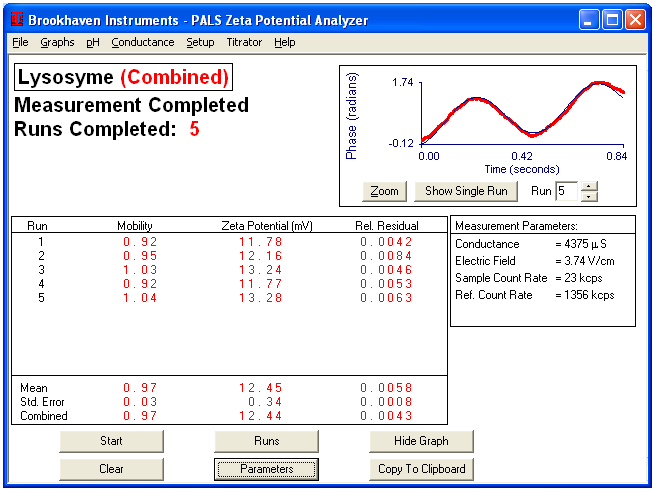
各種蛋白質(zhì)的 Zeta 電位值
| 蛋白質(zhì)種類(在磷酸鹽緩沖液 PBS 中) | Zeta電位值(mV) |
| 雞蛋清溶菌酶 | 5.91 |
| 馬脾脫鐵鐵蛋白 | -13.70 |
| 牛血清白蛋白初提物 | -14.27 |
鹽含量對溶菌酶 Zeta 電位的影響。注意,鹽含量降低會導(dǎo)致 Zeta 電位值升高。
| PBS 濃度 | 溶菌酶的 Zeta 電位值(mV) |
| 1x | 5.91 |
| 0.1x | 12.45 |
結(jié)論
ZetaPALS 可用于測定高鹽體系中蛋白質(zhì)的 Zeta 電位。
ZetaPALS 可用于測定高鹽體系中蛋白質(zhì)的 Zeta 電位。鹽含量降低會導(dǎo)致靜電屏蔽效應(yīng)減弱,從而使 Zeta 電位值升高。
